

 您当前所在的位置:网站首页--新闻中心--行业新闻
您当前所在的位置:网站首页--新闻中心--行业新闻
基于血液瘤临床试验已经取得的突破性进展,我们认为CAR-T疗法成为癌症治疗第五大治疗手段是大概率事件。预计美国血液瘤每年潜在市场空间达到480亿美金(按30万美金/人计),国内血液瘤潜在市场规模达到250亿人民币(按10万元/人计)。
CAR-T是一种非常个性化的疗法,产品的供应方式和传统药物有着根本性的区别。因此,实现CAR-T产品的标准化是首要任务,标准化意味着药效可控、风险可控。未来市场必定属于能够将CAR-T细胞特异化,治疗流程精细化、标准化的企业。当下进行粗放式开发的医院或者企业,在未来必定会被淘汰。
CAR-T疗法具有极强的技术属性,可复制性强,与传统新药研发有着明显不同,对于新药研发刚刚起步的中国,存在弯道超车的可能。目前国内开展的CAR-T临床试验数量已经多达19项,仅次于美国,这也是中国首次在新药研发领域走到国际前列。
目前被用于癌症治疗的普通免疫细胞(NK、DC、CIK等),我们认为,未来会逐渐退出临床治疗。但由于这类免疫细胞客观上能够提升人体免疫力,而且均为自体细胞扩增,回输风险较小,有望在养生保健以及辅助治疗领域取得较大市场。
风险提示:对于CAR-T疗法研发企业,风险来源于临床进展不利;对于普通免疫细胞企业,风险来源于监管从严以及医保控费。
肿瘤免疫治疗的核心是克服免疫逃逸
1.1免疫编辑理论
肿瘤是机体正常细胞恶变的产物,其特点是不断增殖并在体内转移。因此肿瘤细胞在免疫学上的突出特点是会出现一些在同类正常细胞中看不到的新的抗原标志。现已陆续发现的肿瘤抗原包括肿瘤特异性抗原和肿瘤相关抗原。前者为肿瘤细胞所独有;后者大多指胚胎性抗原,为胚胎组织与肿瘤组织所共有。由于肿瘤抗原的存在,势必被机体免疫系统所识别,并由此激发特异性免疫反应,包括细胞免疫和体液免疫两类。肿瘤的体液免疫主要是抗肿瘤抗体对肿瘤细胞的破坏效应;细胞免疫主要指T淋巴细胞、CIK细胞、NK细胞和巨噬细胞等免疫细胞对肿瘤细胞的杀伤作用。
肿瘤细胞表现为基因突变和致癌基因的过表达,这些突变或异常基因表达的蛋白是免疫细胞赖以识别癌细胞的基础。理论上,免疫细胞可以随时清除不正常的细胞,从而把肿瘤消灭于萌芽状态,也即所谓的“免疫监视”。但免疫监视作用并不能完全避免恶性肿瘤的发生,而且肿瘤一旦产生后,会隨病情的发展,恶性程度逐渐增加,最终发生广泛转移。
2002年,美国肿瘤生物学家R.D. Schreiber提出了“肿瘤免疫编辑”理论。根据该理论,免疫系统不但具有排除肿瘤细胞的能力,同时还具有促进肿瘤生长的作用。癌细胞在机体内发生、发展是一个免疫系统与癌细胞一系列动态复杂的相互作用过程。在这个过程中,免疫系统清除一些肿瘤细胞的同时,也对另一些肿瘤细胞的生物学特性(如肿瘤的抗原性)进行重塑,也即所谓的“免疫编辑”。被免疫辑过的肿瘤细胞恶性程度越来越高,对免疫攻击的抵抗力越来越强,直至最终摧毁机体的免疫系统,造成肿瘤细胞的恶性生长并扩散。

肿瘤免疫编辑理论
1.2传统过继性免疫细胞
癌症免疫疗法(Cancer Immunotherapy)是继手术、化疗、放疗和靶向疗法之后出现的一种新型治疗方法,被称为治疗癌症的“第五大疗法”。它是利用患者自身免疫系统的力量来抵抗癌症。免疫治疗经历了多年的不断发展,近几年,取得了越来越多令人鼓舞的研究成果。2013年,癌症免疫疗法被国际顶级学术期刊《Science》杂志评为年度十大科学突破之首。
肿瘤免疫治疗可以广义地分为非特异性和肿瘤抗原特异性两大类。非特异性的手段包括免疫检验点阻断和非特异地激活免疫细胞;而肿瘤抗原特异性的方法主要是各种各样的肿瘤疫苗和过继免疫细胞疗法。
肿瘤过继免疫疗法是将自身或异体的抗肿瘤效应细胞的前体细胞,在体外采用IL-2、抗CD3单抗、特异性多肽等激活剂进行诱导、激活和扩增,然后回输给肿瘤患者,提高患者抗肿瘤免疫力,以达到治疗和预防复发的目的。常见的有如下几种。LAK细胞,用高浓度IL-2激活病人自体或正常供者的外周血单个核细胞。TIL细胞,从切除的瘤组织或癌性胸腹水中分离淋巴细胞,体外经IL-2诱导激活和扩增。DC-CIK细胞,将DC细胞与CIK细胞混合培养,两者能相互调节而增加细胞因子释放和增强细胞毒性,从而显著提高CIK细胞的增殖能力和杀伤活性,临床治疗效果优于CIK等其它效应细胞。CTL细胞,用特异性多肽抗原体外诱导CTL克隆。
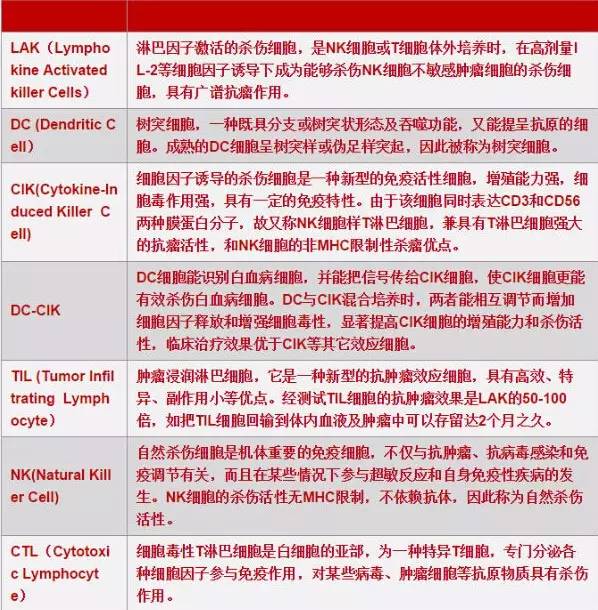
传统过继性免疫细胞
目前,国内有近200家公司在使用传统过继性免疫技术用于癌症临床治疗。一般采取为医疗机构提供免疫细胞治疗技术服务,并收取技术服务费的商业模式。公司选派专业技术人员在医院指定的细胞实验室内,按照医院为肿瘤患者制定的免疫细胞治疗方案,运用自身研发的免疫细胞治疗专利技术,对医院采集的患者血液样本进行细胞分离培养、体外扩增等处理后交还医院;医院将该细胞制剂回输至患者体内。医院支付公司技术服务费,而公司不参与患者的诊断及治疗方案的确定,也不向患者直接收取费用,仅仅作为细胞体外培养环节的技术供应商。

免疫细胞治疗流程
尽管各类传统过继性免疫细胞都对癌症有一定的效果,但是这些细胞的靶向性较差,往往很难表现出较为明显的治疗效果,大多用于辅助治疗或者术后提高机体免疫力,逐渐被欧美主流技术所淘汰。但由于这类免疫细胞客观上能够提升人体免疫力,而且均为自体细胞扩增,回输风险较小,未来有望在养生保健以及辅助治疗领域取得较大市场。
目前,世界各国都在积极开展CAR-T治疗技术开发和临床试验,包括美国、中国、英国、瑞典、日本等。国际制药巨头诺华公司率先和宾夕法尼亚大学合作开发CAR-T细胞免疫疗法的研究。随后礼来、葛兰素史克和辉瑞等医药巨头以及Juno、Kite等小型生物医药公司也竞相加入CAR-T细胞免疫技术研发的行列。这必将推动这一极具发展前景的肿瘤免疫治疗技术尽早进入临床应用阶段,从而为晚期难治性恶性肿瘤患者带来希望。
1.3 CAR-T:接过癌症免疫治疗大旗
T淋巴细胞是肿瘤细胞的天敌,在肿瘤免疫应答中起主要作用,对肿瘤细胞有极强的杀伤作用。但是,使用内源性T细胞进行肿瘤免疫治疗时,靶抗原需经过加工处理后才能和靶细胞表面的主要组织相容性复合物(main histocompatibility complex,MHC)作用,也即“MHC限制性”。然而,肿瘤免疫编辑的过程会使MHC在肿瘤细胞表面表达下降,破坏抗原加工过程,降低肽段免疫原性。这样长期形成的免疫逃逸机制,能使肿瘤细胞成功躲避T细胞攻击,肿瘤快速增殖。此外,人体内肿瘤特异性的T细胞数量较少,并且由于大多数肿瘤细胞不断表达自体抗原,使得靶向这些抗原的T细胞通过免疫耐受机制被中和或移除,数量进一步减少。因此,包括细胞因子诱导的杀伤细胞在内的T细胞过继性免疫治疗虽然在部分肿瘤的治疗中取得了一定的效果,但在大多数肿瘤中疗效尚不能令人满意。
CAR-T,全称ChimericAntigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。通过将识别肿瘤相关抗原(tumor-associated antigen,TAA,是指一些肿瘤细胞表面糖蛋白或糖脂成分,它们在正常细胞上有微量表达,但在肿瘤细胞表达明显增高。)的scFv和胞内信号域“免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAM,通常为CD3ζ或FcεRIγ)”在体外进行基因重组,生成重组质粒,再在体外通过转染技术转染到患者的T细胞,使患者T细胞表达肿瘤抗原受体。转染后经过纯化和大规模扩增后的T细胞,也即CAR-T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向性、杀伤活性和持久性较常规应用的免疫细胞大幅提高,并可克服肿瘤局部免疫抑制微环境,从而打破宿主免疫耐受状态,杀灭肿瘤细胞。
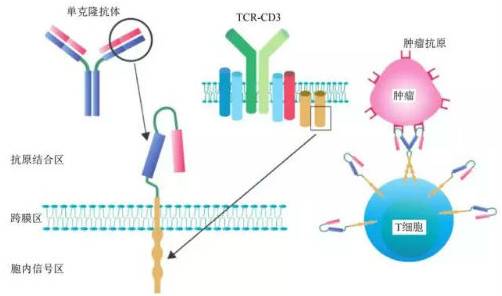
完整的CAR-T结构包括抗原结合区、跨膜链接区和胞内信号区三个部分。
1.3.1四代CAR-T 技术演进
研究表明,T细胞的完全活化有赖于双信号和细胞因子的作用。其中第一信号为特异性信号,由TCR识别抗原递呈细胞表面的抗原肽-MHC复合物所启动;第二信号为协同刺激信号,通过CD28/B7等重要的共刺激分子,促进IL-2合成,并使T细胞充分活化及免于凋亡。对于初始型T细胞(未与抗原接触的T细胞),如只在信号1而没有信号2条件下无法使T细胞发挥正常作用;即使T细胞与抗原接触, 如果没有协同刺激信号,细胞也不能发挥正常功能。相应的,仅含有CD3ζ序列的嵌合抗原受体,如没有协同刺激信号2,也是无法激活CAR-T细胞。因此,依照T细胞活化的双信号学说,第二和第三代CARs在嵌合受体上加上如CD28、CD134(OX40)和CD137(4-1BB)等共刺激分子(costimulatory molecule,CM),增加共同刺激因子的目的是提高T细胞的细胞毒性、增殖活性, 维持T细胞应答,延长T细胞存活时间等,从而增强CAR-T的效果。
三代CAR-T胞内信号区变化
目前已经在开发的第四代CAR-T技术,包括整合表达免疫因子、整合共刺激因子配体等。可以想象,未来还会有更多的共刺激因子以及其他精确调控方式的加入,这也凸显了CAR-T的技术属性。
1.3.2 CAR-T治疗流程
一个典型的CAR-T治疗流程,主要分为以下五个步骤。
①分离:从癌症病人身上分离免疫T细胞。
②修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。
③扩增:体外培养,大量扩增CAR-T细胞。一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大,需要细胞越多)。
④回输:把扩增好的CAR-T细胞回输到病人体内。
⑤监控:严密监护病人,尤其是控制前几天身体的剧烈反应。
整个疗程持续3个星期左右,其中细胞“提取-修饰-扩增”需要约2个星期,花费时间较长。
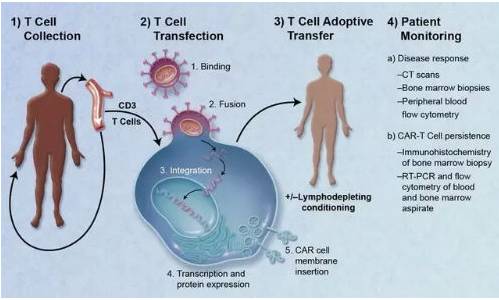
CAR-T治疗流程
1.3.3 CAR-T临床进展
CAR-T疗法是由美国宾夕法尼亚大学终身教授、美国科学院院士Carl June教授和他的团队首创。后来越来越多的科学家、医院和药企参与到CAR-T技术开发当中。随着不断取得的突破性进展,越来越多的投资机构也看到了这一疗法的前景,资金不断涌入,加速推动了技术进步。
说到CAR-T的临床进展,首先必须要提EmilyWhitehead的故事。5岁时,艾米丽被诊断出急性淋巴细胞白血病,在进行首轮化疗时受到感染,差点失去双腿。后来病情复发,她又接受了治疗,并排期做骨髓移植手术。等待期间,病情再次复发,这时医生们已经无计可施。随后接受Carl June的CART19细胞回输,Emily的体内发生了超强的免疫反应,连续几天发高烧,不得不入院治疗。高烧下的她产生了幻觉,问爸爸:“我房间里怎么有池塘?”经历了噩梦般的连续高烧后,Emily最终挣脱了死神的束缚重新醒了过来。现在Emily已经9岁,还在健康成长,体内仍然能检测到存活的CAR-T细胞。

CAR-T疗法发明人Carl June和治愈的Emily Whitehead
发表在Science上的文章“TheDizzying Journey to a New Cancer Arsenal”详细的记录了Carl June和他的团队关于CAR-T临床试验的研发过程。其中关于Emily的部分摘录如下…... Emily Whitehead, a 6-year-old with end stage leukemia whoseparents turned to June’s cell therapy as a last-ditch hope. The experimentaltreatment sent her body into a deadly immune overdrive. She spent 2 weeks on aventilator in the CHOP intensive care unit while doctors tried everything theycould think of to save her. “We thought it was over,” June says. Hedrafted an e-mail message to Penn’s provost: “It is with regret that I informyou that our fi rst pediatric patient on the CART19 trial will likely die,” hewrote. “There is nothing to do at this point other than hope for amiracle.”…... (Science.2013. 340. 1514-1518)
去年以来,几乎每月、甚至每星期都能听到CAR-T临床的新进展以及新技术的开发。现摘取其中一小部分如下。
2014年12月10日,在第56届美国血液学会年会(ASH)上,诺华(Novartis)公布了其CAR-T免疫疗法CTL019的最新临床数据。在这些研究中,CTL019在某些类型淋巴细胞白血病表现出了巨大的治疗潜力。在一项长期儿科研究中,39例复发/难治(r/r)急性淋巴细胞白血病(ALL)儿科患者接受了CTL019的治疗,数据显示,有36例患者经历了完全缓解(CR),比例高达92%(n=36/39)。
2015年5月21日,在英国伦敦举行的第十届世界干细胞与再生医学大会,西比曼(Cellular Biomedicine Group)的首席执行官曹卫公布了其CAR-TCD30霍奇金淋巴瘤免疫-肿瘤研发项目的I期临床数据。7名患者中有5人对CAR-CD30 T细胞疗法有应答。该试验由中国解放军总医院设计并执行,项目主要负责人是该院癌症免疫治疗部门的主任韩卫东教授。
2015年6月2日,在美国临床肿瘤学会(ASCO)年会上,纪念斯隆凯特林癌症中心(MSKCC)公布了其CAR-T细胞治疗复发及难治性B细胞型非霍奇金淋巴瘤的临床一期实验结果。8名患者在大剂量化疗和自体造血干细胞移植后接受治疗,其中5名患者完全缓解(62.5%)。部分病人期间经历细胞因子风暴,通过使用 tocilizumab联合皮质类固醇治疗得到了有效控制。
Carl June教授在今年接受采访时表示:“CAR-T技术2010年开始做第一次临床实验,估计2017年美国FDA通过,只用7年的时间,这样是很快的。
>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>
